чем обусловлено большое разнообразие белков
Чем обусловлено разнообразие молекул белка? Какие связи и взаимодействия обеспечивают стабилизацию различных типов пространственной организации белка?
Белки – биологические полимеры, мономерами которых являются аминокислоты. В ходе образования белка аминокислоты взаимодействуют между собой, образуя пептидные связи, в результате чего формируется длинная полипептидная цепь. Разнообразие белковых молекул обеспечивают следующие факторы:
2. Количество аминокислот
3. Последовательность соединения аминокислот
Белки или протеины (что в переводе с греческого означает первые или важнейшие ), количественно преобладают над всеми другими макромолекулами, присутствующими в живой клетке, и составляют более половины сухого веса большинства организмов. Белки служат теми инструментами, посредством которых генетическая информация получает свое реальное воплощение. В соответствии с тем, что в клеточном ядре содержатся тысячи генов, каждый из которых определяет какой-то один характерный признак живого организма, в клетке существуют тысячи белков и каждый из них выполняет специфическую функцию:
Актин является глобулярным белком с молекулярной массой 42 000. В таком виде его называют G-актином. Однако он обладает способностью полимеризоваться, образуя длинную структуру, называемую F-актином. В такой форме актин способен взаимодействовать с головкой миозина, причем важной чертой этого процесса является зависимость от присутствия АТФ. При достаточно высокой концентрации АТФ комплекс, образованный актином и миозином, разрушается. После того как под действием миозиновой АТФазы (фермент) произойдет гидролиз АТФ, комплекс снова восстанавливается. Этот процесс легко наблюдать в растворе, содержащем оба белка. В отсутствии АТФ в результате образования высокомолекулярного комплекса раствор становится вязким. При добавлении АТФ вязкость резко понижается в результате разрушения комплекса, а затем начинает постепенно восстанавливаться по мере гидролиза АТФ. Эти взаимодействия играют важную роль в процессе мышечного сокращения.
Антитела построены из четырех полипептидных цепей, связанных между собой дисульфидными мостиками.
Согласно современным представлениям, каждый тип иммуноглобулина вырабатывается группой В-лимфоцитов, произошедших от одного общего предшественника. Такую группу лимфоцитов называют клоном. Первые успехи в изучении строения иммуноглобулинов были связаны с изучением иммуноглобулинов, полученных от больных миеломой (патология, связанная со сверхпродукцией определенного вида иммуноглобулинов). У больных, от одного злокачественно разросшегося клона В-лимфоцитов, вырабатывается огромное количество индивидуального иммуноглобулина, который сравнительно легко отделить от остальных. Далее производили слияние клеток миеломы как носителей способности к неограниченному размножению с нормальными В-лимфоцитами как носителями программы выработки антител определенной, задаваемой экспериментатором специфичности. Получающиеся клетки, гибридомы сохраняют способность к неограниченному размножению и вырабатывают при этом только определенные антитела. Так как гибридомы происходят из одной слитой клетки, то они представляют собой единый клон; получающиеся из них антитела поэтому называют моноклональными антителами (МАТ).
энергетическая ценность белков составляет 17,6 кДж/г; суточная потребность в белке равна 80-100г
Многообразие функций белков
Вопрос 1. Чем объясняется многообразие функций белков?
Уникальные свойства белков заложены в колоссальном разнообразии пространственного строения их молекул. Это разнообразие белков определяется огромным числом возможных сочетаний аминокислотных остатков в длинных, состоящих, как правило, из нескольких сотен остатков, полипептидных цепях белков. Как известно, в состав белков может входить 20 видов аминокислот. Белки образуют различные соединения с различными веществами. Кроме того, белки могут иметь пространственную структуру молекулы. Установлено, что белки могут иметь различные размеры и форму. Многие белки содержат в своём составе такие металлы, как железо, цинк, медь и др. Все это способствует тому, что белки выполняют множество функций.
Вопрос 2. Какие функции белков вам известны?
1. Строительная (пластическая) функция. Белки являются непременным компонентом всех биологических мембран, составляют основу цитоскелета, входят в состав соединительных тканей, волосяного покрова, т.е. обеспечивают «строительную» функцию.
2. Ферментативная функция. Обладая, прежде всего, ярко выраженной каталитической способностью, они в качестве ферментов детерминируют интенсивность всех метаболических процессов в клетке и организме в целом. Белки служат ферментами, т. е. биологическими катализаторами. Примером может служить амилаза, расщепляющая крахмал до моносахаридов; пепсин, расщепляющий белки на пептиды.
3. Сократительная (двигательная) функция. Все виды движения, начиная с движений жгутиков бактерий и кончая движениями пальцев пианиста, обеспечиваются работой «белковых моторов» (сократительные белки). Сократительные свойства белков актина и миозина лежат в основе работы мышц.
4. Транспортная функция. Белки участвуют в транспорте молекул и ионов в пределах организма (гемоглобин переносит кислород из легких к органам и тканям, альбумин сыворотки крови участвует в транспорте жирных кислот).
5. Защитная функция. Она заключается в предохранении организма от повреждений и вторжения чужеродных белков и бактерий. Белки-антитела, вырабатываемые лимфоцитами, создают защиту организма от чужеродной инфекции, тромбин и фибрин участвуют в образовании тромба, тем самым, помогая организму избежать больших потерь крови.
6. Регуляторная функция. Белки-гормоны участвуют в регуляции активности клетки и всех жизненных процессов организма. Так, инсулин регулирует уровень сахара в крови и поддерживает его на определенном уровне.
7. Сигнальная функция. Белки формируют ионные каналы и осуществляют восприятие, трансформацию и передачу разнообразных внешних сигналов (белки-рецепторы).
8. Энергетическая функция. Она реализуется белками крайне редко. При полном расщеплении 1г белка способно выделиться 17,6кДж энергии. Однако белки для организма — очень ценное соединение. Поэтому расщепление белка происходит обычно до аминокислот, из которых строятся новые полипептидные цепочки. Они же осуществляют иммунологическую защиту от чужеродных соединений и патогенных микроорганизмов (защитные белки-иммуноглобулины).
Вопрос 3. Какую роль играют белки-гормоны?
Белки-гормоны контролирует физиологическую активность тканей и органов и всех жизненных процессов всего организма. Так, в организме человека соматотропин участвует в регуляции роста тела, инсулин поддерживает на постоянном уровне содержание глюкозы в крови.
Вопрос 4. Какую функцию выполняют белки-ферменты?
Белки-ферменты играют роль катализаторов, т. е. ускоряют химические реакции в сотни миллионов раз. Ферменты обладают строгой специфичностью по отношению к веществу, вступающему в реакцию. Каждая реакция катализируется своим ферментом.
§ 4. Структура и свойства белков
| Сайт: | Профильное обучение |
| Курс: | Биология. 11 класс |
| Книга: | § 4. Структура и свойства белков |
| Напечатано:: | Гость |
| Дата: | Пятница, 3 Декабрь 2021, 07:07 |
Оглавление
Белки *(протеины)* — это полипептиды, в состав молекул которых входит множество остатков аминокислот (до нескольких тысяч). * Белки — нерегулярные биополимеры.* Они различаются количеством аминокислотных звеньев, их составом и последовательностью расположения. При этом каждый белок имеет особый, присущий только ему порядок чередования аминокислот.
Уровни структурной организации белковых молекул. Для того чтобы белок мог выполнять свою биологическую функцию, его молекула должна иметь определенную пространственную конфигурацию. Различают четыре основных уровня организации белковых молекул — первичную, вторичную, третичную и четвертичную структуры (рис. 4.1).
Первичная структура белка — это строго определенная последовательность аминокислотных остатков в линейной полипептидной цепи. Каждый белок обладает уникальной первичной структурой. Ее существование обусловлено наличием прочных пептидных связей между остатками аминокислот. Все последующие, более сложные структуры формируются на основе первичной. Поэтому изменение первичной структуры (например, замена одних аминокислотных остатков на другие) приводит к изменению формы молекулы, свойств и функций белка.
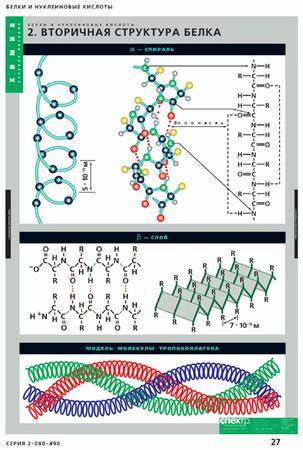
Вторичная структура белка формируется за счет образования многочисленных водородных связей между атомами водорода NH-групп и атомами кислорода CO-групп разных аминокислотных остатков. Несмотря на то что эти связи слабее ковалентных, их количество обеспечивает стабильность вторичной структуры.
Чаще всего водородные связи возникают внутри одной полипептидной цепи между близко расположенными остатками аминокислот, что приводит к закручиванию этой цепи в так называемую α-спираль.
Иногда водородные связи возникают между относительно удаленными друг от друга участками полипептидной цепи (или нескольких разных цепей). *Данные участки могут располагаться параллельно (если полипептидные цепи идут в одном направлении, например, от N-конца к C-концу) либо антипараллельно (если цепи имеют противоположное направление: одна идет от N-конца к С-концу, а соседняя наоборот).* При этом формируется складчатая структура, напоминающая гармошку. Такой тип вторичной структуры получил название β-складчатый слой (см. рис. 4.1).
*α-спиральные и β-структурные участки белковой молекулы могут взаимодействовать друг с другом и между собой, образуя упорядоченные структуры (ансамбли). Например, α-спиральные фрагменты могут объединяться в двойные или тройные спирали. На основе β-участков часто образуются структуры, имеющие вид шпилек, арок, зигзагов и др. Участки, имеющие α- и β- строение, могут формировать ансамбли состава αβ, βαβ, βαβαβ и т. п. Эти пространственные конфигурации представляют собой так называемую сверхвторичную структуру белка.
Ансамбли сверхвторичной структуры являются основой для формирования в молекулах белков доменов. Это структурно и функционально обособленные области, соединенные друг с другом короткими фрагментами полипептидной цепи — шарнирными участками.
Например, молекулы мембранных белков-рецепторов чаще всего состоят из трех доменов. Надмембранный домен обеспечивает прием внешних сигналов, внутримембранный закрепляет белок в мембране, подмембранный осуществляет передачу сигнала внутрь клетки. Другим примером может служить сывороточный альбумин — белок плазмы крови, способный связываться с высшими карбоновыми кислотами, билирубином, некоторыми токсинами и другими соединениями и доставлять их в те или иные органы. Молекула этого белка содержит три домена, каждый из которых отвечает за избирательное связывание с определенными веществами.*
Многие белки способны выполнять свои биологические функции, обладая третичной структурой. Но некоторым белкам для этого необходимо объединение в единый комплекс двух или более молекул, имеющих третичную структуру. Так возникает четвертичная структура белка. Молекулы, входящие в ее состав *(их называют субъединицами или протомерами)*, могут быть одинаковыми или разными. Они удерживаются вместе благодаря различным видам нековалентных связей — водородным, ионным, гидрофобным взаимодействиям и др. В некоторых белках, например иммуноглобулинах, к множеству таких связей добавляются несколько ковалентных дисульфидных. Примером белка, имеющего четвертичную структуру, может служить гемоглобин (рис. 4.3).
Многообразие и свойства белков. В зависимости от состава различают простые и сложные белки. Молекулы простых белков построены только из аминокислотных остатков *(кератин, коллаген, фибрин, альбумины крови и др.)*. В состав сложных белков, кроме того, входит какой-либо компонент неаминокислотной природы *— так называемая простетическая группа. Более подробная информация о сложных белках приведена в таблице 4.1.*
*Таблица 4.1. Основные группы сложных белков
Название
Простетическая группа
Примеры
ДНК-полимераза (содержит Mg 2+ ),
трансферрин (содержит Fe 3+ )
Казеин молока, вителлин яичного желтка
Антитела ( иммуноглобулины ), муцин слюны
Тромбопластин, липопротеины клеточных мембран
Окрашенный небелковый компонент (пигмент)
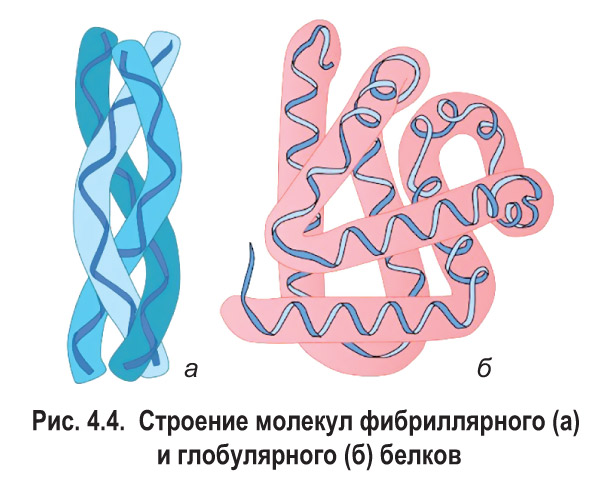
Многие белки хорошо растворяются в воде, однако среди них есть и нерастворимые — кератин, фибрин и др. Известно, что глобулярные белки в основном являются водорастворимыми, а фибриллярные, как правило, в воде не растворяются.
Белки чувствительны к внешним воздействиям: изменение химического состава среды, температуры и других факторов вызывает изменение их структуры и свойств. Действие высоких и низких температур, сильных кислот и щелочей, ионов тяжелых металлов, ультрафиолетового излучения, радиации ведет к разрушению связей, стабилизирующих пространственную конфигурацию белков. Вследствие разрыва водородных, ионных, дисульфидных и других связей белок может последовательно утратить свою четвертичную, третичную и даже вторичную структуру. Процесс нарушения природной структуры белка под влиянием внешних факторов без разрушения его первичной структуры называется денатурацией (рис. 4.5).
Пространственная структура белка определяет его физико-химические свойства и биологические функции. Поэтому денатурация приводит не только к изменению размеров и формы молекул белка, но и его свойств, например растворимости. Неполярные гидрофобные группы, которые располагались внутри молекулы, оказываются на ее поверхности, и белок становится менее гидрофильным. Важно то, что в результате денатурации белки теряют способность выполнять свои функции.
Степень денатурации белка зависит от силы воздействия на него различных факторов: чем интенсивнее их действие, тем глубже денатурация. В ряде случаев она становится необратимой. Однако если фактор, вызвавший денатурацию, действовал непродолжительно, то после прекращения его воздействия белок может восстановить свою природную структуру, свойства и функции. Такое явление называется ренатурацией. Развернутая полипептидная цепь способна самопроизвольно восстановить вторичную структуру, а затем уложиться в третичную. Это означает, что пространственная конфигурация белка определяется его первичной структурой, т. е. последовательностью аминокислотных остатков. Если же воздействие на белок было слишком жестким и привело к разрыву пептидных связей, возвращение белковой молекулы к исходной структуре становится невозможным.
*Большинство белков денатурирует при нагревании выше 50—60 °С. Но, например, денатурация сократительных белков мышц начинается уже при 45—50 °С, а яичный белок денатурирует при температуре 60—70 °С. Белки некоторых термофильных бактерий, обитающих в горячих источниках, могут полноценно функционировать при температурах выше 90 °С!
Явление денатурации широко используется в медицине, биохимических исследованиях, пищевой промышленности и других сферах деятельности человека.
Применение таких антисептиков, как спирт, хлорамин, формалин и т. п., основано на том, что они вызывают денатурацию белков и, вследствие этого, гибель микроорганизмов. То же самое происходит под действием высоких температур при стерилизации медицинских инструментов и материалов. Ультрафиолетовое излучение используется в качестве денатурирующего агента для дезинфекции помещений, промышленного обеззараживания воды и т. д.
Денатурацию белков может вызвать и присоединение к ним ионов тяжелых металлов. При этом они прочно связываются с выпадающим в осадок денатурированным белком. Поэтому при пищевом отравлении соединениями ртути, свинца, меди пострадавшему как можно быстрее дают выпить молоко или раствор яичного белка для того, чтобы ограничить дальнейшее всасывание токсичных веществ.
Осаждение белков при денатурации также применяется в лабораторной практике. Оно позволяет удалять белки из различных жидкостей биологического происхождения (например, плазмы крови, ликвора), что облегчает процессы выделения и анализа других веществ, входящих в состав таких жидкостей. Кроме того, осаждение белков используется для определения их количественного содержания в биологическом материале.
*Радикалы ряда аминокислот, входящих в состав белковой молекулы, содержат оснóвные и кислотные функциональные группы. Поэтому белки, как и аминокислоты, являются амфотерными соединениями. Амфотерность придает белкам буферные свойства.
Снижение кислотности среды усиливает диссоциацию групп —СООН. При этом высвобождаются дополнительные ионы водорода и заряд белковой молекулы становится отрицательным. Таким образом, белки способны в определенной степени поддерживать уровень рН среды. Например, альбумины и глобулины участвуют в поддержании слабощелочной реакции плазмы крови (совместно с другими буферными системами).*
*При определенном значении pH количество положительно и отрицательно заряженных групп в молекуле белка становится одинаковым, и его суммарный электрический заряд оказывается равным нулю. Такое значение pH называют изоэлектрической точкой белка (см. рис. 4.6). Каждый белок имеет определенное значение изоэлектрической точки, которое определяется аминокислотным составом. Изоэлектрические точки белков, в составе которых преобладают остатки кислых аминокислот, располагаются в области pH 7.
У большинства белков значение изоэлектрической точки находится в пределах 5,5—7,0. Но, например, для пепсина (фермента желудочного сока) величина изоэлектрической точки равна 1, а для сальмина (белка, содержащегося в молóках семги) — почти 12.
Чем больше значение рН среды отличается от изоэлектрической точки, тем больший заряд имеет белок. Из-за этого между белковыми молекулами существует электростатическое отталкивание, препятствующее их слипанию (агрегации). В изоэлектрической точке силы отталкивания минимальны. Из-за этого белки наименее устойчивы в растворе, их молекулы легко слипаются и выпадают в осадок.*