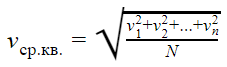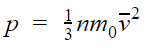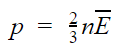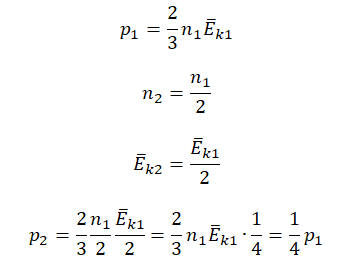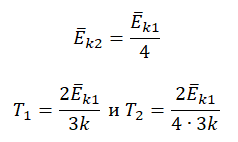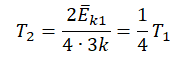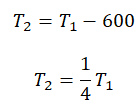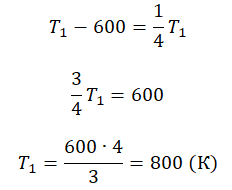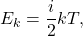что значит идеальный газ
Идеальный газ
Газ: агрегатное состояние
У веществ есть три агрегатных состояния — твердое, жидкое и газообразное.
Их характеристики — в таблице:
Агрегатные состояния
Свойства
Расположение молекул
Расстояние между молекулами
Движение молекулы
Твердое
сохраняет форму и объем
в кристаллической решетке
соотносится с размером молекул
колеблется около положения в кристаллической решетке
Жидкое
близко друг к другу
молекулы малоподвижны, при нагревании скорость движения увеличивается
Газообразное
занимает предоставленный объем
больше размеров молекул
хаотичное и непрерывное
В жизни мы встречаем вещества в газообразном состоянии, когда чувствуем запахи. Запах очень легко распространяется, потому что газ не имеет ни формы, ни объема (занимает весь предоставленный объем) и состоит из хаотично движущихся молекул, расстояние между которыми больше, чем размеры молекул.
Агрегатных состояний точно три?
На самом деле есть еще четвертое — плазма. Звучит как что-то из научной фантастики, но это просто ионизированный газ — газ, в котором, помимо нейтральных частиц, есть еще и заряженные. Ионизаторы воздуха как раз строятся на принципе перехода из газообразного вещества в плазму.
Модель идеального газа
В физике есть такое понятие, как модель. Модель — это что-то идеализированное, она нужна в случаях, когда можно пренебречь некоторыми параметрами объекта или процесса.
Идеальный газ — это модель реального газа. Молекулы идеального газа представляют собой материальные точки, которые не взаимодействуют друг с другом на расстоянии, но взаимодействуют при столкновениях друг с другом или со стенками сосуда. При работе с идеальным газом можно пренебречь потенциальной энергией молекул (но не кинетической).
В повседневной жизни идеальный газ, конечно, не встречается. Но реальный газ может вести себя почти как идеальный. Такое случается, если среднее расстояние между молекулами во много раз больше их размеров, то есть если газ очень разреженный.
Свойства идеального газа
Среднеквадратичная скорость
Потенциальной энергией молекул газа пренебречь можно, а вот кинетической — никак нельзя. Потому что кинетическая энергия — это энергия движения, а мы не можем пренебрегать скоростью движения молекул.
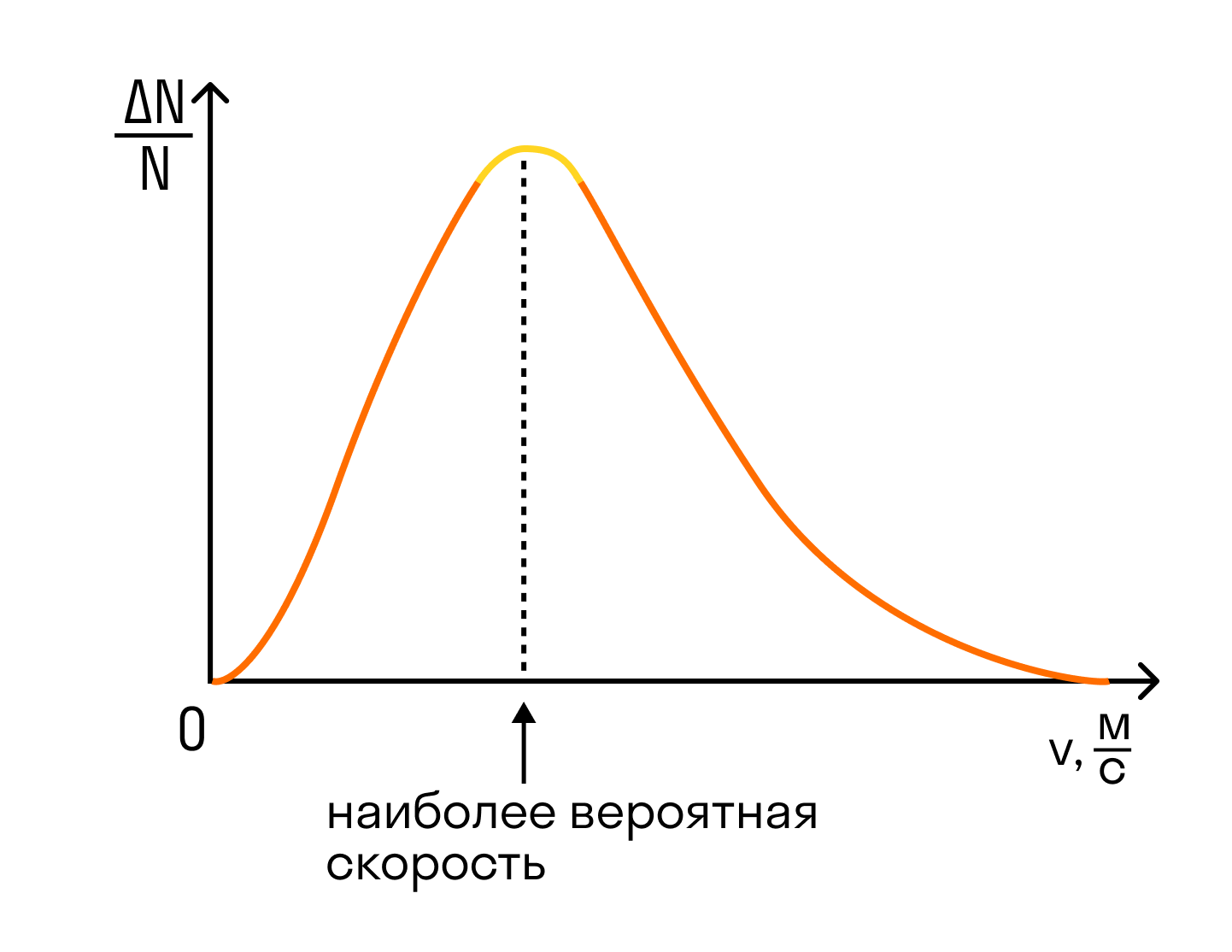
На графике показано распределение Максвелла — то, как молекулы распределяются по скоростям. Судя по графику, большинство молекул движутся со средним значением скорости. Хотя есть и быстрые, и медленные молекулы, просто их значительно меньше.
Но наш газ идеальный, а в идеальном газе случаются чудеса. Одно из таких чудес — то, что все молекулы идеального газа двигаются с одинаковой скоростью. Эта скорость называется средней квадратичной.
Средняя квадратичная скорость
v1, v2, vn — скорости разных молекул [м/с]
N — количество молекул [-]
Давление идеального газа
Молекулы газа беспорядочно движутся. Во время движения они сталкиваются друг с другом, а также со стенками сосуда, в котором этот газ находится. Поскольку молекул много, ударов тоже много.
Например, в комнате, в которой вы сейчас находитесь, за одну секунду на каждый квадратный сантиметр молекулы воздуха наносят столько ударов, что их количество выражается двадцатитрехзначным числом.
Хотя сила удара отдельной молекулы мала, действие всех молекул на стенки сосуда приводит к значительному давлению. Представьте, что комар пытается толкать машину — она не сдвинется с места. Но если за работу возьмется пара сотен миллионов комаров, то машину получится сдвинуть.
Эксперимент
Чтобы смоделировать давление газа, возьмите песок и лист бумаги, зажатый между двумя книгами. Песчинки будут выступать в роли молекул газа, а лист — в роли сосуда, в котором этот газ находится. Когда вы начинаете сыпать песок на лист бумаги, бумага отклоняется под воздействием множества песчинок. Так же и молекулы газа оказывают давление на стенки сосуда, в котором находятся.
Зависимость давления от других величин
Зависимость давления от объема
В механике есть формула давления, которая показывает, что давление прямо пропорционально силе и обратно пропорционально площади, на которую эта сила оказывается.
Давление
p = F/S
F — сила [Н]
S — площадь [м2]
То есть если наши двести миллионов комаров будут толкать легковую машину, они распределятся по меньшей площади, чем если бы толкали грузовой автомобиль, — просто потому, что легковушка меньше грузовика. Из формулы давления следует, что давление на легковой автомобиль будет больше из-за его меньшей площади.
Рассмотрим аналогичный пример с двумя сосудами разной площади.
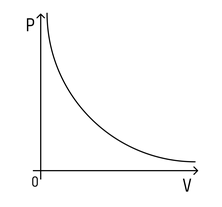
Давление в левом сосуде будет больше, чем во втором, потому что его площадь меньше. А раз меньше площадь сосуда, то меньше и его объем. Значит, давление зависит от объема следующим образом: чем больше объем, тем меньше давление, и наоборот.
При этом зависимость будет не линейная, а примет вот такой вид (при условии, что температура постоянна):
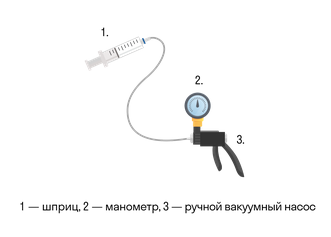
Зависимость давления от объема называется законом Бойля-Мариотта. Она экспериментально проверяется с помощью такой установки:
Объем шприца увеличивают с помощью насоса, а манометр измеряет давление. Эксперимент показывает, что при увеличении объема давление действительно уменьшается.
Зависимость давления от температуры
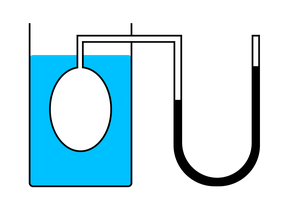
Рассмотрим зависимость давления газа от температуры при условии неизменного объема определенной массы газа. Исследования в этой области впервые провел французский изобретатель Жак Шарль в XVIII веке.
В ходе эксперимента газ нагревали в большой колбе, соединенной с ртутным манометром в виде узкой изогнутой трубки. Незначительным увеличением объема колбы при нагревании можно пренебречь, как и столь же незначительным изменением объема при смещении ртути в узкой манометрической трубке. Таким образом, объем газа можно считать неизменным.
Подогревая воду в сосуде, окружающем колбу, ученый измерял температуру газа термометром, а давление — манометром.
Эксперимент показал, что давление газа увеличивается с увеличением температуры. Это связано с тем, что при нагревании молекулы газа движутся быстрее, из-за чего чаще ударяются о стенки сосуда.
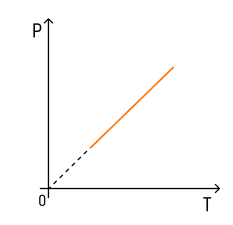
С температурой все проще. Зависимость давления от температуры при постоянных объеме и массе будет линейной:
Эта зависимость называется законом Шарля в честь ученого, открывшего ее.
Основное уравнение МКТ
Основная задача молекулярно-кинетической теории газа заключается в том, чтобы установить соотношение между давлением газа и его микроскопическими параметрами: массой молекул, их средней скоростью и концентрацией. Это соотношение называется основным уравнением молекулярно-кинетической теории газа или кратко — основным уравнением МКТ.
В основе молекулярно-кинетической теории лежат три положения.
Молекулы химического вещества могут быть простыми и сложными, то есть состоять из одного или нескольких атомов. Молекулы и атомы представляют собой электрически нейтральные частицы. При определенных условиях молекулы и атомы могут приобретать дополнительный электрический заряд и превращаться в положительные или отрицательные ионы.
Мы уже выяснили, что причина давления газа на стенки — это удары молекул. Давление напрямую зависит от количества молекул — чем их больше, тем больше ударов о стенки и тем больше давление. А количество молекул в единице объема — это концентрация. Значит, давление газа зависит от концентрации.
Также давление пропорционально квадрату скорости, так как чем больше скорость молекулы, тем чаще она бьется о стенку сосуда. Расчеты показывают, что основное уравнение молекулярно-кинетической теории для идеального газа имеет следующий вид.
Основное уравнение МКТ
p = nkT
p — давление газа [Па]
T — температура газа [К]
m 0 — масса одной молекулы [кг]
v — средняя квадратичная скорость [м/с]
Коэффициент 1/3 обусловлен трехмерностью пространства: во время хаотического движения молекул все три направления равноправны.
Важный нюанс: средняя квадратичная скорость сама по себе не в квадрате! Ее формула указана выше, а в основном уравнении МКТ (да и не только в нем) она возведена в квадрат. Это значит, что формулу средней квадратичной скорости нужно подставлять не вместо v2, а вместо v— и потом уже возводить эту формулу в квадрат. Это часто провоцирует путаницу.
Мы знаем, что кинетическая энергия вычисляется по следующей формуле:
Кинетическая энергия
Ек = mv 2 /2
Ек — кинетическая энергия [Дж]
m — масса тела [кг]
v — скорость [м/с]
Для молекулы газа формула примет вид:
Средняя кинетическая энергия поступательного движения молекулы
Ек — средняя кинетическая энергия поступательного движения молекулы [Дж]
m0 — масса молекулы [кг]
v — скорость молекулы [м/с]
Из этой формулы можно выразить m0v 2 и подставить в основное уравнение МКТ. Подставим и получим, что давление идеального газа пропорционально произведению концентрации молекул на среднюю кинетическую энергию поступательного движения молекулы.
Основное уравнение МКТ
p — давление газа [Па]
n — концентрация [м-3]
E — средняя кинетическая энергия поступательного движения молекулы [Дж]
Хранение и транспортировка газов
Если нужно перевезти значительное количество газа из одного места в другое или если газ необходимо длительно хранить, его помещают в специальные прочные металлические сосуды. Из-за того, что при уменьшении объема увеличивается давление, газ можно закачать в небольшой баллон, но он должен быть очень прочным.
Сосуды, предназначенные для транспортировки газов, выдерживают высокие давления. Поэтому с помощью специальных насосов (компрессоров) туда можно закачать значительные массы газа, которые в обычных условиях занимали бы в сотни раз больший объем.
Поскольку давление газов в баллонах даже при комнатной температуре очень велико, их ни в коем случае нельзя нагревать. Например, держать под прямыми лучами солнца или пытаться сделать в них отверстие — даже после использования.
Идеальный газ
Полезное
Смотреть что такое «Идеальный газ» в других словарях:
ИДЕАЛЬНЫЙ ГАЗ — теор. модель газа, в к рой не учитывается вз ствие ч ц газа (ср. кинетич. энергия ч ц много больше энергий их вз ствия). Различают классич. и квант. И. г. Св ва классического И. г. описываются законами классич. физики Клапейрона уравнением и его… … Физическая энциклопедия
идеальный газ — Невязкий нетеплопроводный газ, при движении которого возникают только нормальные напряжения. Примечание В идеальном газе вектор силы, действующей на любую выбранную в нем площадку, ортогонален к этой площадке. [ГОСТ 23281 78] Тематики… … Справочник технического переводчика
ИДЕАЛЬНЫЙ ГАЗ — идеализированная модель газа; в идеальном газе силы взаимодействия между частицами (атомами, молекулами) пренебрежимо малы. К идеальному газу близки разреженные реальные газы при температурах, далеких от температуры их конденсации. Зависимость… … Большой Энциклопедический словарь
Идеальный газ — Термодинамика Статья является частью одноименной сер … Википедия
идеальный газ — идеализированная модель газа; в идеальном газе силы взаимодействия между частицами (атомами, молекулами) пренебрежимо малы. К идеальному газу близки разреженные реальные газы при температурах, далёких от температуры их конденсации. Зависимость… … Энциклопедический словарь
идеальный газ — idealiosios dujos statusas T sritis fizika atitikmenys: angl. ideal gas; perfect gas vok. ideales Gas, n; vollkommenes Gas, n rus. идеальный газ, m; совершенный газ, m pranc. gaz idéal, m; gaz parfait, m … Fizikos terminų žodynas
Идеальный газ — понятие физики, в узком смысле, теоретическая модель газа, в которой пренебрегают размерами и взаимодействиями частиц газа и учитывают лишь их упругие столкновения. В широкой трактовке, идеальный газ состоит из частиц, представляющих собой… … Концепции современного естествознания. Словарь основных терминов
идеальный газ — idealiosios dujos statusas T sritis Standartizacija ir metrologija apibrėžtis Dujos, kurių dalelės nesąveikauja tarpusavyje. atitikmenys: angl. ideal gas; perfect gas vok. ideales Gas, n rus. идеальный газ, m pranc. gaz parfait, m … Penkiakalbis aiškinamasis metrologijos terminų žodynas
идеальный газ — idealiosios dujos statusas T sritis chemija apibrėžtis Dujos, kurių molekulės tarpusavyje nesąveikauja. atitikmenys: angl. ideal gas; perfect gas rus. идеальный газ … Chemijos terminų aiškinamasis žodynas
идеальный газ — idealiosios dujos statusas T sritis Energetika apibrėžtis Dujos, kurių dalelės nesąveikauja. Joms galioja idealiųjų dujų lygtis (Klapeirono lygtis). atitikmenys: angl. ideal gas vok. ideales Gas, n rus. идеальный газ, m pranc. gaz idéal, m … Aiškinamasis šiluminės ir branduolinės technikos terminų žodynas
Идеальный газ — газ, в котором взаимодействием молекул можно пренебречь, а обмен энергией совершается только при упругих столкновениях молекул. К идеальному газу близки разреженные газы, вдали от температуры их конденсации … Начала современного естествознания
Основное уравнение МКТ идеального газа
теория по физике 🧲 молекулярная физика, МКТ, газовые законы
Идеальный газ — газ, удовлетворяющий трем условиям:
Реальный газ с малой плотностью можно считать идеальным газом.
Измерение температуры
Температуру можно измерять по шкале Цельсия и шкале Кельвина. По шкале Цельсия за нуль принимается температура, при которой происходит плавление льда. По шкале Кельвина за нуль принимается абсолютный нуль — температура, при котором давление идеального газа равно нулю, и его объем тоже равен нулю.
Цена деления обеих шкал составляет 1 градус. Поэтому изменение температуры в градусах Цельсия равно изменению температуры в Кельвинах:
При решении задач в МКТ используют значения температуры по шкале Кельвина. Если в условиях задачи температура задается в градусах Цельсия, нужно их перевести в Кельвины. Это можно сделать по формуле:
Если особо важна точность, следует использовать более точную формулу:
Пример №1. Температура воды равна o C. Определить температуру воды в Кельвинах.
T = t + 273 = 2 + 273 = 275 (К)
Основное уравнение МКТ идеального газа
Давление идеального газа обусловлено беспорядочным движением молекул, которые сталкиваются друг с другом и со стенками сосуда. Основное уравнение МКТ идеального газа связывает давление и другие макропараметры (объем, температуру и массу) с микропараметрами (массой молекул, скоростью молекул и кинетической энергией).
Основное уравнение МКТ
Давление идеального газа пропорционально произведению концентрации молекул на среднюю кинетическую энергию поступательного движения молекулы.
p — давление идеального газа, n — концентрация молекул газа, − E k — средняя кинетическая энергия поступательного движения молекул.
Выражая физические величины друг через друга, можно получить следующие способы записи основного уравнения МКТ идеального газа:
m 0 — масса одной молекулы газа;
n — концентрация молекул газа;
− v 2 — среднее значение квадрата скорости молекул газа.
Среднее значение квадрата скорости не следует путать со среднеквадратичной скоростью v, которая равна корню из среднего значения квадрата скорости:
k — постоянная Больцмана (k = 1,38∙10 –3 Дж/кг)
T — температура газа по шкале Кельвина
Пример №2. Во сколько раз уменьшится давление идеального одноатомного газа, если среднюю кинетическую энергию теплового движения молекул и концентрацию уменьшить в 2 раза?
Согласно основному уравнению МКТ идеального газа, давление прямо пропорционально произведению средней кинетической энергии теплового движения молекул и концентрации его молекул. Следовательно, если каждая из этих величин уменьшится в 2 раза, то давление уменьшится в 4 раза:
Следствия из основного уравнения МКТ идеального газа
Через основное уравнение МКТ идеального газа можно выразить скорость движения молекул (частиц газа):
R — универсальная газовая постоянная, равная произведения постоянной Авогадро на постоянную Больцмана:
Температура — мера кинетической энергии молекул идеального газа:
Полная энергия поступательного движения молекул газа определяется формулой:
Пример №3. При уменьшении абсолютной температуры на 600 К средняя кинетическая энергия теплового движения молекул неона уменьшилась в 4 раза. Какова начальная температура газа?
Запишем формулу, связывающую температуру со средней кинетической энергией теплового движения молекул, для обоих случаев, с учетом что:
Составим систему уравнений:

Алгоритм решения
Решение
График построен в координатах (V;Ek). Процесс 1–2 представляет собой прямую линию, исходящую из начала координат. Это значит, что при увеличении объема растет средняя кинетическая энергия молекул. Но из основного уравнения МКТ идеального газа следует, что мерой кинетической энергии молекул является температура:
Следовательно, когда кинетическая энергия молекул растет, температура тоже растет.
Запишем уравнение Менделеева — Клапейрона:
Так как количество вещества одинаковое для обоих состояния 1 и 2, запишем:
Мы уже выяснили, что объем и температура увеличиваются пропорционально. Следовательно, давление в состояниях 1 и 2 равны. Поэтому процесс 1–2 является изобарным, давление во время него не меняется.
Процесс 2–3 имеет график в виде прямой линии, перпендикулярной кинетической энергии. Так как температуры прямо пропорциональна кинетической энергии, она остается постоянной вместе с этой энергией. Следовательно, процесс 2–3 является изотермическим, температура во время него не меняется. Мы видим, что объем при этом процессе уменьшается. Но так как объем и давление — обратно пропорциональные величины, то давление на участке 2–3 увеличивается.
pазбирался: Алиса Никитина | обсудить разбор | оценить
Первоначальное давление газа в сосуде равнялось р1. Увеличив объём сосуда, концентрацию молекул газа уменьшили в 3 раза, и одновременно в 2 раза увеличили среднюю энергию хаотичного движения молекул газа. В результате этого давление р2 газа в сосуде стало равным
Понятие идеального газа как физической идеализации.
Из трех агрегатных состояний, в которых может находиться вещество, наиболее простым для изучения является газообразное. Поэтому изучение свойств веществ мы начинаем именно с свойств газов. В разреженного газа расстояние между молекулами во много раз превышает их размеры. В этом случае взаимодействие между молекулами очень мала и кинетическая энергия движения молекул значительно превышает потенциальную энергию их взаимодействия. Молекулы газа можно рассматривать как маленькие твердые шарики. Вместо реального газа мы будем рассматривать его физическую модель, пренебрегая сложными силами взаимодействия между молекулами и облегчая тем самым изучения свойств газов. Эта модель называется идеальным газом.
Идеальный газ — это газ, взаимодействием между молекулами в котором можно пренебречь.
Газ можно считать идеальным, если:
Следует помнить, что в физической модели учитывают те свойства реальной системы, учет которых необходимо для объяснения закономерностей поведения системы, исследуются.
Условия, при которых реальные газы можно считать идеальными
Газами, свойства которых близки к свойствам идеального газа, реальные газы, находящиеся под низким давлением имеют высокую температуру. Например, воздух при нормальных условиях (105 Па и 0 ° С) можно приближенно считать идеальным газом.
Вопросы на которые стоит ответить самому себе:
Тепловое равновесие и температура как термодинамический параметр идеального газа.
Состояние газа описывают с помощью определенных величин, называют параметрами состояния. различают:
Со словом «температура» вы знакомы с раннего детства. Теперь ознакомимся с температурой как параметром.
Следовательно, температура характеризует состояние теплового равновесия: все тела находятся в тепловом равновесии, имеют одинаковую температуру.
Тепловое равновесие — это состояние, при котором все макроскопические параметры остаются сколь угодно долго неизменными. Состояние теплового равновесия определяется для изолированной системы, то есть только для тел, которые взаимодействуют только между собой и не взаимодействуют с другими телами.
Следовательно, температура характеризует внутреннее состояние изолированной системы тел, находящихся в состоянии теплового равновесия. Чем быстрее движутся молекулы в теле, тем сильнее есть ощущение тепла во время соприкосновения с ним. Большая скорость движения молекул соответствует большей кинетической энергии. Согласно по величине температуры можно составить представление о кинетической энергии молекул.
Во всех частях системы, находящейся в тепловом равновесии, температура одинакова.
В молекулярно-кинетической теории температура —
это величина, обусловленная средней кинетической энергией частиц, из которых состоит система:
де 
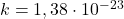
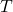
Температура — это мера кинетической энергии теплового движения молекул.
Температура является скалярной величиной, в СИ измеряется в градусах Кельвина.
Основное уравнение молекулярно-кинетической теории (МКТ) выражет зависимость давление газа (

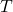
Закон Авогадро: в равных объемах газа при одинаковой температуре и давлении содержится одинаковое количество молекул:
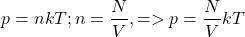
Концентрация (