обструкция мочевыводящих путей что это такое лечение
Обструктивная уропатия – когда нужно срочно обращаться к врачу
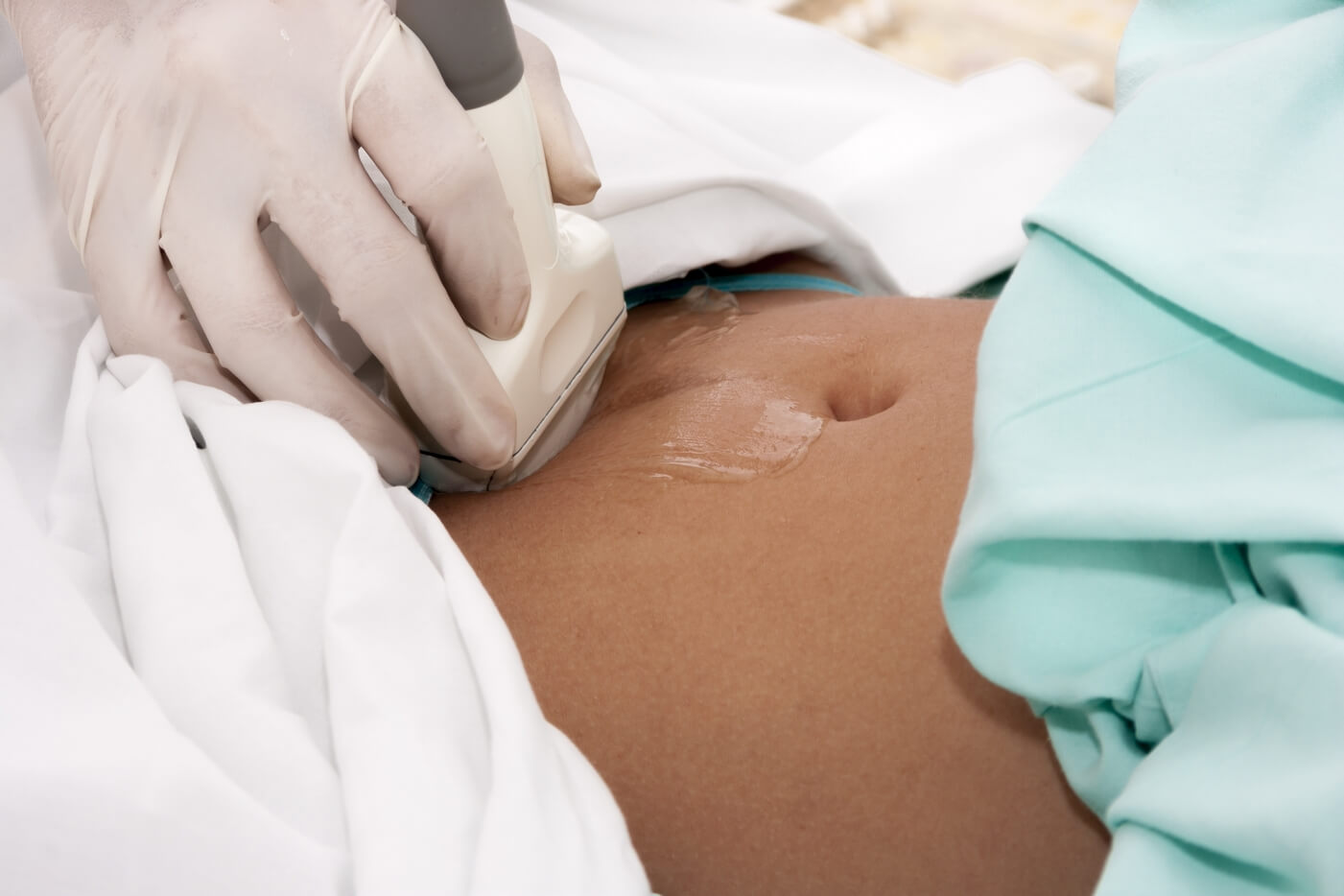
Обструктивная уропатия – состояние, при котором закупорка препятствует прохождению мочи по мочевыводящему каналу. Возникает в любом участке системы – от почек, где моча образуется, до канала, через который она покидает организм. Состояние повышает давление в мочевыделительном канале и угрожает осложнениями, если вовремя не будет диагностировано.
Причины
Причины развития обструктивной уропатии и рефлюкс-уропатии отличаются в разных возрастных группах:
Обструктивная уропатия у мужчин встречается чаще, у женщин же она часто встречается во время беременности. Это связано с давлением плода и матки на мочевыводящий канал.
Дополнительно причинами заболевания становятся:
Новообразования в простате у мужчин и в матке у женщин способны сужать просвет мочеточника, потому врач проводит дифференциальную диагностику с определением сопутствующих заболеваний и первопричин.
Непроходимость мочевыводящих путей – симптомы
Признаки уропатии зависят от локализации, продолжительности состояния. Пациентов беспокоят такие симптомы:
Если непроходимость возникает быстро, она причиняет боль и описанные состояния. При медленно прогрессирующей уропатии болезненность не отмечается на первых стадиях. В этом случае заболевание угрожает гидронефрозом.
Нарушение оттока мочи – повод немедленно обратиться к урологу! Патология может развиваться критически быстро, но своевременная диагностика и лечение предотвратят острые состояния и осложнения.
Диагностика
Для обнаружения обструктивной уропатии у мужчин и женщин назначаются лабораторные и инструментальные обследования:
В клинике урологии имени Р. М. Фронштейна Первого Московского Государственного Медицинского Университета имени И.М. Сеченова можно пройти диагностику и получить консультацию опытного уролога. Современные диагностические аппараты, врачи высшей категории помогут справиться с заболеванием на любой стадии в короткие сроки. Не откладывайте визит к врачу, позаботьтесь о здоровье сегодня!
Лечение функциональных нарушений опорожнения мочевого пузыря
Лечение больных с функциональными нарушениями опорожнения мочевого пузыря является насущной проблемой нейроурологии. Это связано с тем, что до настоящего времени не разработано эффективных и этиопатогенетически обоснованных методов лечения таких больных
Лечение больных с функциональными нарушениями опорожнения мочевого пузыря является насущной проблемой нейроурологии. Это связано с тем, что до настоящего времени не разработано эффективных и этиопатогенетически обоснованных методов лечения таких больных.
Выделяют нейрогенные, миогенные (миопатии) и психогенные (неврозы, шизофрения, истерия и др.) факторы, лежащие в основе функциональных нарушений опорожнения мочевого пузыря. Нейрогенные нарушения и повреждения — основная причина таких нарушений. В отсутствие причины функциональных нарушений опорожнения мочевого пузыря следует думать об идиопатических формах заболевания.
Согласно классификации Международного общества по удержанию мочи, функциональные нарушения опорожнения мочевого пузыря — это результат недостаточной функции мочевого пузыря, гиперактивности уретры или следствие комплексного воздействия обоих нарушений [1]. Недостаточная функция мочевого пузыря возникает вследствие снижения или отсутствия сократительной способности детрузора (арефлексия), которые встречаются при локализации повреждения или неврологического поражения в области фронтальных долей и моста головного мозга, сакрального отдела спинного мозга, при повреждении волокон конского хвоста, тазового сплетения и нервов мочевого пузыря, а также при рассеянном склерозе. Гиперактивность уретры — это следствие наружной детрузорно-сфинктерной диссинергии (ДСД) или нерасслабляющегося (спастического) поперечно-полосатого (п/п) сфинктера уретры, также может проявиться как вариант синдрома Фоулера у женщин. При этом наружная ДСД наблюдается при супрасакральном уровне поражения спинного мозга.
В литературе имеются лишь единичные сообщения о распространенности функциональных нарушений опорожнения мочевого пузыря. Так, P. Klarskov и соавт., оценивая обращаемость в лечебные учреждения Копенгагена, выявили, что ненейрогенные формы нарушения опорожнения мочевого пузыря встречаются в среднем у 7 женщин на 100 000 населения [2]. По данным T. Tammela и соавт., после оперативных вмешательств на органах брюшной полости нарушения опорожнения мочевого пузыря встречаются у 2,9 % пациентов, а после проктологических операций — у 25% больных [3]. Многие авторы считают данную проблему особенно значимой у неврологических больных.
Клиническим проявлением снижения сократительной способности детрузора и нерасслабляющегося п/п сфинктера уретры являются симптомы нарушения опорожнения мочевого пузыря, к которым относятся затрудненное мочеиспускание тонкой, вялой струей, прерывистое мочеиспускание, необходимость прилагать усилия и натуживаться, чтобы начать мочеиспускание, ощущение неполного опорожнения мочевого пузыря.
При отсутствии сократительной способности детрузора в сочетании с паралитическим состоянием п/п сфинктера уретры больные опорожняют мочевой пузырь, искусственно увеличивая внутрибрюшное давление, что клинически проявляется мочеиспусканием слабой струей мочи. При отсутствии сократительной способности детрузора в сочетании со спастическим состоянием наружного сфинктера уретры в большинстве случаев самостоятельное мочеиспускание невозможно и отмечается хроническая задержка мочи.
Нерасслабляющийся п/п сфинктер уретры приводит к инфравезикальной обструкции с симптомами нарушения опорожнения мочевого пузыря.
Клинические проявления наружной ДСД (непроизвольное сокращение п/п сфинктера уретры во время мочеиспускания или непроизвольного сокращения детрузора) включают два вида симптомов, а именно: нарушения опорожнения и накопления мочи в мочевом пузыре. Последние включают учащенное и ургентное мочеиспускание нередко в сочетании с ургентным недержанием мочи и никтурией. Для наружной ДСД характерно неполное опорожнение мочевого пузыря и развитие пузырно-мочеточникового рефлюкса.
Таким образом, различные формы нарушения опорожнения мочевого пузыря могут иметь во многом сходную клиническую картину. В связи с этим правильная и своевременная диагностика функциональных нарушений опорожнения мочевого пузыря является залогом успешного лечения.
Диагностика функциональных нарушений опорожнения мочевого пузыря складывается из сбора жалоб и анамнеза, урологического и неврологического обследования, а также дополнительных методов обследования, среди которых основное место занимает уродинамическое исследование. На начальном этапе обследования обязательна оценка симптомов нижних мочевых путей на основании вопросника I-PSS (Internanional Prostate Symptom Score). Вопросник I-PSS был предложен для оценки нарушений акта мочеиспускания вследствие заболеваний предстательной железы, однако в настоящее время он с успехом применяется и в случаях проявления симптомов заболеваний нижних мочевых путей, вызванных различными факторами, в том числе и неврологического характера.
Для уточнения поведения детрузора и его сфинктеров в фазу опорожнения мочевого пузыря наиболее информативным методом исследования больных является комплексное уродинамическое исследование.
Уродинамическими признаками наружной ДСД, характерной для надкрестцовой локализации патологического процесса, особенно в шейном отделе спинного мозга, являются регистрируемые с помощью электромиографии во время мочеиспускания «всплески» сократительной активности п/п сфинктера уретры и мышц тазового дна. Сокращение мышц тазового дна затрудняет или полностью прерывает поток мочи. Для нерасслабляющегося сфинктера уретры характерно отсутствие снижения электромиографической активности п/п сфинктера уретры во время мочеиспускания. Снижение или отсутствие сократительной способности детрузора уродинамически проявляется отсутствием плавного повышения детрузорного давления в ходе цистометрии или отсутствием позыва к акту мочеиспускания.
Следует подчеркнуть, что только уродинамическое обследование дает возможность достоверно установить форму нарушения функции нижних мочевых путей, приводящих к нарушению опорожнения мочевого пузыря, и во многом определить выбор метода лечения.
Ультразвуковое исследование почек и мочевого пузыря, также как и экскреторная урография, позволяет уточнить анатомическое состояние верхних мочевых путей и количество остаточной мочи в мочевом пузыре. По количеству остаточной мочи в мочевом пузыре после акта мочеиспускания (в норме до 50 мл) можно косвенно судить о функциональном состоянии детрузора и наличии инфравезикальной обструкции.
В таблице перечислены методы лечения больных с функциональными нарушениями опорожнения мочевого пузыря, из которых только медикаментозная терапия и дорзальная ризотомия с электростимуляцией передних корешков могут действительно считаться методами лечения, тогда как другие скорее являются способами опорожнения мочевого пузыря. При этом даже медикаментозная терапия во многом является симптоматическим методом лечения. Несмотря на это, назначение лекарственных средств представляет собой первый этап лечения больных с функциональными нарушениями опорожнения мочевого пузыря. Выбор медикаментов зависит от вида нарушения функции нижних мочевых путей. Так, в случае нарушения сократительной способности детрузора применяют антихолинэстеразные средства и М-холиномиметики, а при гиперактивности уретры — центральные миорелаксанты и α-блокаторы.
У 22 больных со сниженной сократительной способностью детрузора использовали дистигмина бромид (убретид) в дозе 5 мг через день за 30 мин до завтрака в течение 2 мес. При этом через каждые 2 нед делали 7-дневный перерыв в приеме препарата. Механизм действия дистигмина бромида заключается в блокировании ацетилхолинэстеразы, что сопровождается увеличением концентрации ацетилхолина в синаптической щели и соответственно приводит к облегчению передачи нервного импульса.
У всех больных терапевтический эффект развивался в первую неделю приема препарата и выражался в снижении среднего балла I-PSS c 15,9 до 11,3, а количества остаточной мочи — с 82,6 до 54,3 мл. Субъективно пациенты отмечали усиление ощущения позыва и облегчение начала акта мочеиспускания.
Следует отметить, что до настоящего времени остается открытым вопрос о продолжительности лечения антихолинэстеразными средствами. По нашим данным, у 82% больных в разные сроки после окончания 2-месячного курса лечения отмечалось возобновление симптомов, потребовавшее повторного назначения препарата.
К сожалению, мы не накопили собственного опыта применения бетанехола у больных со сниженной сократительной способностью детрузора, так как данный препарат не зарегистрирован для клинического применения в нашей стране и соответственно отсутствует в аптечной сети. Механизм действия бетанехола аналогичен действию ацетилхолина на гладкие миоциты. Данные других авторов показывают, что бетанехол может применяться при лечении больных с легкой степенью нарушения сократительной способности детрузора [4, 5].
α1-адреноблокатор доксазозин (кардура) использовали в ходе лечения 30 больных с гиперактивностью уретры, в том числе 14 пациентов с наружной ДСД и 16 с нарушением произвольного расслабления п/п сфинктера уретры. Доксазозин назначали в дозе 2 мг/сут на ночь.
Через 6 мес средний балл по шкале I-PSS у больных с наружной ДСД снизился с 22,6 до 11,4, количество остаточной мочи уменьшилось с 92,6 до 32,4 мл, а максимальная скорость потока мочи увеличилась с 12,4 до 16,0 мл/сек.
Кроме того, через 6 мес у больных с нарушением произвольного расслабления п/п сфинктера уретры средний балл I-PSS снизился с 14,6 до 11,2, количество остаточной мочи — с 73,5 до 46,2 мл, а максимальная скорость потока мочи увеличилась с 15,7 до 18,4 мл/сек.
Баклофен и тизанидин (сирдалуд) являются центральными миорелаксантами. Они снижают возбуждение моторных нейронов и интернейронов и могут ингибировать передачу нервного импульса в спинном мозге, уменьшая спастичность п/п мышц. По нашим данным, после применения баклофена в дозе 20 мг/сут и тизанидина в дозе 4 мг/сут не было выявлено существенной динамики субъективных и объективных симптомов как у больных с наружной ДСД, так и у пациентов с нарушением расслабления п/п сфинктера уретры. Выраженная слабость мускулатуры конечностей на фоне приема этих препаратов не позволяет увеличивать дозу препаратов, что существенно ограничивает их применение в клинической практике.
Следует отметить, что медикаментозная терапия эффективна у больных с начальными и легкими формами нарушения опорожнения мочевого пузыря. Тем не менее ее целесообразно использовать в качестве первого этапа лечения. В случае недостаточной эффективности медикаментозной терапии необходимо искать новые пути решения проблемы адекватного опорожнения мочевого пузыря.
Предложенная Lapides и соавт. в 80-е гг. прошлого столетия интермиттирующая аутокатетеризация мочевого пузыря до настоящего времени остается одним из основных методов опорожнения мочевого пузыря [6]. Однако этот метод имеет ряд осложнений, к которым относятся инфекции нижних мочевых путей, стриктуры уретры и, самое главное, значительное снижение качества жизни. При невозможности выполнения (неврологические больные с тетраплегией, больные с ожирением) или отказе пациента от аутокатетеризации, у лиц с наружной ДСД и нерасслабляющимся сфинктером уретры, а также со сниженной сократительной способностью детрузора для адекватного опорожнения мочевого пузыря применяют в последние годы имплантацию специальных стентов (производства фирм Balton, Mentor, МедCил) и инъекции ботулинического токсина в зону п/п сфинктера уретры.
 |
| Рисунок 1. Временный уретральный стент |
Временные уретральные стенты имеют форму цилиндра, выполненного из проволочной спирали толщиной 1,1 мм, изготовлены они на основе полимолочной и полигликоликовой кислот с различным периодом разрушения (от 3 до 9 мес) посредством гидролиза (рис. 1). Механические свойства и время разрушения временных стентов зависят от степени поляризации, места и формы зоны имплантации.
Мы имеем опыт применения временных уретральных стентов у семи мужчин с наружной ДСД и у четырех пациентов, у которых отсутствовала сократительная способность детрузора. Временный уретральный стент устанавливали при уретроцистоскопии таким образом, чтобы он «шинировал» как простатический, так и мембранозный отделы уретры. Такое положение стента обеспечивает адекватное опорожнение мочевого пузыря.
У всех больных отмечалось восстановление самостоятельного мочеиспускания сразу после имплантации уретрального стента. Пациенты с наружной ДСД осуществляли мочеиспускание по позыву, а больные с отсутствием сократительной способности детрузора с интервалом 4 ч (6 раз в сутки) с использованием приема Креда. По данным ультразвукового сканирования, через 10 нед после установки стента у больных с наружной ДСД не отмечалось остаточной мочи, а у больных с отсутствием сократительной способности детрузора среднее количество остаточной мочи составило 48 мл и зависело от адекватности выполнения приема Креда. Очень важно, что у больных с наружной ДСД было выявлено снижение максимального детрузорного давления во время мочеиспускания в среднем с 72 до 35 см вод. ст. (профилактика развития пузырно-мочеточникового рефлюкса).
Мы считаем, что временные уретральные стенты обеспечивают адекватное опорожнение мочевого пузыря и показаны тем больным с нарушением опорожнения мочевого пузыря, которым не может быть выполнена интермиттирующая катетеризация мочевого пузыря или которые воздерживаются от нее по различным причинам. Временные стенты могут являться методом отбора больных для установки постоянных (металлических) стентов.
В последние годы в литературе появились сообщения об успешном использовании ботулинического токсина у больных с функциональными нарушениями опорожнения мочевого пузыря. В нашей клинике ботулинический токсин применялся у 16 больных с нарушением опорожнения мочевого пузыря, в том числе у девяти с наружной ДСД, у трех с нерасслабляющимся п/п сфинктером уретры и у четырех с нарушением сократительной способности детрузора. Мы использовали ботулинический токсин типа А фармацевтической фирмы Allergan. Коммерческое название препарата — ботокс (Botox), он представляет собой лиофилизированный порошок белого цвета в вакуумных стеклянных флаконах объемом 10 мл, закрытых резиновой пробкой и герметичным алюминиевым затвором. В одном флаконе содержится 100 ЕД ботулинического токсина типа А.
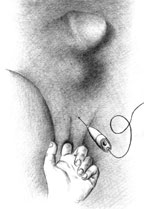 |
| Рисунок 2. Введение ботулинического токсина у мужчин |
Механизм действия ботокса заключается в блокировании выброса ацетилхолина из пресинаптической мембраны в нервно-мышечном синапсе. Фармакологическим эффектом этого процесса является стойкая хемоденервация, а клиническим проявлением — расслабление мышечных структур.
Согласно рекомендациям фирмы-производителя, лиофилизированный порошок разводили 8 мл стерильного 0,9% раствора натрия хлорида без консервантов (1 мл полученного раствора содержит 12,5 ЕД ботокса). Использовали трансперинеальную методику введения препарата. У мужчин под контролем указательного пальца, введенного в прямую кишку, специальную иглу с изоляционным покрытием вводили в точку, находящуюся на 2 см латеральнее и выше анального отверстия (рис. 2). У женщин иглу под контролем указательного пальца, введенного во влагалище, вводили в точку на 1 см латеральнее и выше наружного отверстия уретры на глубину 1,5–2,0 см (рис. 3). Во всех случаях положение иглы контролировали электромиографически по характерному звуку динамика электромиографа. В каждую точку вводили по 50 ЕД ботокса.
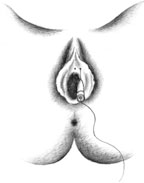 |
| Рисунок 3. Введение ботулинического токсина у женщин |
У всех больных через 10 дней после введения ботулинического токсина исчезла остаточная моча и было отмечено увеличение максимальной скорости потока мочи. Важно, что хемоденервация сфинктера уретры после инъекции ботокса у всех пациентов с нерасслабляющимся п/п сфинктером и наружной ДСД приводила к снижению детрузорного давления, а у больных с нарушением сократительной способности детрузора — к снижению максимального абдоминального давления, вызывающего выделение мочи из наружного отверстия уретры. Это наблюдение представляется крайне важным в отношении профилактики развития пузырно-мочеточникового рефлюкса и сохранения функциональной способности почек. Только у одного больного клинический эффект после инъекции ботокса продолжал сохраняться на протяжении 16 мес, остальным пациентам потребовались повторные инъекции препарата с периодичностью 3–8 мес.
В отдельных случаях, при выраженной инвалидизации больных с нарушением опорожнения мочевого пузыря, используют трансуретральную инцизию или резекцию наружного сфинктера уретры, дренируют мочевой пузырь постоянным уретральным катетером или выполняют цистостомию.
Таким образом, нарушение опорожнения мочевого пузыря может быть следствием различных форм дисфункции нижних мочевых путей. Требуются проведение комплексного уродинамического обследования для уточнения функционального состояния мочевого пузыря и его сфинктеров и выбор адекватного метода опорожнения мочевого пузыря. Отсутствие высокоэффективных и универсальных способов лечения больных с функциональными нарушениями опорожнения мочевого пузыря диктует необходимость поиска новых методов терапии таких больных.
Г. Г. Кривобородов, доктор медицинских наук
М. Е. Школьников, кандидат медицинских наук
РГМУ, Москва
Инфекция мочевых путей и ее лечение в возрастном аспекте
Рассмотрены виды инфекций мочевых путей, эпидемиология заболевания, факторы риска, этиология, патогенез. Описаны клиническая картина острого и хронического пиелонефрита. Приведены подходы к лечению инфекций мочевых путей у различных групп пациентов, включ
Are examined the forms of the infections of urinary tracts, epidemiology of disease, factors of risk, etiology, pathogenesis. Are described the clinical picture of acute and chronic pyelonephritis. Approaches to the treatment of the infections of urinary tracts in the different groups of patients are given, including children and pregnant women.
Термином «инфекция мочевых путей» (ИМП) обозначают воспалительный процесс, локализующийся в различных отделах мочевыделительной системы. Выделяют инфекцию нижних (цистит, уретрит) и верхних мочевых путей (пиелонефрит, абсцесс и карбункул почки, апостематозный пиелонефрит). Пиелонефрит — инфекционно-воспалительный процесс, протекающий преимущественно в чашечно-лоханочной системе и интерстиции почки.
В структуре инфекционной заболеваемости ИМП занимает второе место, уступая лишь респираторным инфекциям, в то время как собственно пиелонефрит встречается во много раз реже. В структуре внутрибольничных инфекций доля ИМП может достигать 40%.
По возникновению выделяют внебольничные (возникающие в амбулаторных условиях) и нозокомиальные (развивающиеся после 48 ч пребывания пациента в стационаре) ИМП. В США на долю ИМП приходится более 7 млн визитов к врачу в год, из которых более 2 млн связаны с циститом, в то время как собственно пиелонефрит является причиной более 100 000 госпитализаций в год [14]. Около 15% всех амбулаторно назначаемых в США антибиотиков, общей стоимостью более 1 млрд долларов, выписываются по поводу ИМП [20]. Не менее 40% всех нозокомиальных инфекций обусловлены ИМП, вызванной в большинстве случаев катетеризацией мочевого пузыря [15, 20, 22].
По характеру течения ИМП делятся на неосложненную и осложненную. Неосложненная ИМП развивается, как правило, у людей без обструктивных уропатий и структурных изменений в почках и мочевыводящих путях. Осложненные инфекции возникают у больных с обструктивными уропатиями, мочекаменной болезнью, поликистозом почек, доброкачественной гиперплазией предстательной железы (ДГПЖ), на фоне катетеризации мочевого пузыря и/или при инструментальных (инвазивных) методах исследования, а также у больных с сопутствующими заболеваниями, такими как сахарный диабет, подагра, другие метаболические нарушения. У мужчин любые ИМП обычно трактуются как осложненные.
Пиелонефрит и ИМП — не равнозначные понятия, хотя клинически установить уровень, на котором протекает воспалительный процесс, особенно в амбулаторных условиях, бывает чрезвычайно сложно. Поэтому зачастую во многих странах предпочитают избегать топической диагностики, говоря о неосложненной, осложненной и рецидивирующей ИМП.
Эпидемиология. Распространенность ИМП зависит от возраста и пола (табл.). Если в первые 3 месяца жизни мальчики болеют в полтора раза чаще девочек, то в последующие месяцы эти показатели уравниваются, а к концу 1 года жизни частота ИМП среди девочек уже в 3–4 раза выше, чем у мальчиков. После первого года жизни встречаемость ИМП у девочек в десять и более раз превышает таковую у мальчиков. В целом распространенность ИМП в детской популяции составляет 20–22 случая на 1000 детей. Известно, что у 8% девочек и 2% мальчиков до семилетнего возраста отмечается хотя бы один эпизод ИМП, а в период от 0 до 2 месяцев жизни около 5% случаев фебрильной лихорадки обусловлены развитием острого пиелонефрита. В дальнейшем примерно у 30% детей с ИМП в течение первого года жизни отмечается ее рецидив. ИМП является самой частой причиной лихорадки неясного генеза у мальчиков до трех лет [2, 6, 10, 24]. Весомая доля случаев ИМП в детском возрасте, особенно у мальчиков, развивается на фоне различных морфофункциональных нарушений органов мочевой системы, поэтому мальчикам после одного эпизода, а девочкам после двух эпизодов ИМП показано полное нефроурологическое обследование.
Среди взрослой популяции женщины в 30–50 раз чаще, чем мужчины, страдают от ИМП, а в течение жизни до 60% женщин сталкиваются с эпизодом ИМП. У каждой четвертой пациентки этой возрастной группы в течение года ИМП рецидивирует [18]. В пожилом и старческом возрасте частота ИМП у женщин и мужчин постепенно сравнивается, что обусловлено развивающейся практически в 100% ДГПЖ, нарушающей уродинамику. В целом ИМП, включая пиелонефрит, регистрируется существенно чаще у женщин, чем у мужчин. И если острый пиелонефрит зачастую возникает у людей без почечного анамнеза, то развитию хронического процесса способствует наличие обструкции мочевых путей, аномалий и нарушения структуры почечной ткани. Предрасполагают к развитию пиелонефрита повторные эпизоды инфекции в нижележащих отделах мочевой системы, состояния, влияющие на иммунитет.
Факторы риска ИМП
Этиология. Неосложненные ИМП более чем в 95% случаев вызываются грамотрицательными микроорганизмами из семейства Enterobacteriacеae, причем основным возбудителем является Escherichia coli, названная в честь австрийского педиатра Теодора Эшериха (Theodor Escherich). E. сoli, постоянный обитатель толстого отдела кишечника человека и животных, вызывает неосложненную ИМП в 80–90% случаев. Значительно реже при неосложненной ИМП выделяют Staphylococcus saprophyticus (3–5%), Klebsiella spp., Proteus mirabilis и др.
Со стороны макроорганизма имеется ряд факторов, препятствующих инфицированию мочевых путей. К ним относятся:
Патогенез. Попадание микробов в мочевую систему возможно гематогенным и лимфогенным путем, однако чаще всего ИМП развивается при восходящем распространении из уретры бактерий кишечной группы.
У девочек и женщин важную роль в инфицировании мочевых путей играют особенности строения наружных половых органов и уретры. Близость наружного отверстия мочеиспускательного канала к анальному отверстию и влагалищу объясняет практически 100% микробное обсеменение дистальных отделов уретры, а малая длина и относительно большой диаметр допускают проникновение инфекции в мочевой пузырь. В связи с этим особое значение для девочек раннего возраста имеет правильность гигиенического ухода в период пеленания и прививание соответствующих гигиенических навыков.
Гематогенное инфицирование почек обычно происходит на фоне системных инфекций, протекающих с бактериемией. В этих случаях, как правило, развивается острый гнойный пиелонефрит, тяжело протекающий и сопровождающийся высокой лихорадкой, лейкоцитозом и явлениями общей интоксикации.
Острый пиелонефрит. Собственно острый пиелонефрит, обычно развивающийся на фоне препятствий оттоку мочи, или после диагностических манипуляций на мочевых путях, или на фоне системных инфекций, протекает типично, начинаясь в 80% случаев с потрясающего озноба, повышения температуры нередко до 39–40 °С, интенсивных болей в пояснице, симптомов общей интоксикации — слабости, разбитости, болей в суставах и мышцах. Больные жалуются на расстройства мочеиспускания — дизурию, поллакиурию и т. д., обезвожены, наблюдается умеренное вздутие живота, повышение тонуса поясничных мышц, вынужденное сгибание и приведение ноги к туловищу на стороне поражения. Симптом поколачивания положительный. У 10% больных с острым обструктивным пиелонефритом возникает бактериемический шок с падением АД, снижением адекватной перфузии почек и развитием острой почечной недостаточности. Необструктивный пиелонефрит протекает с менее выраженной клинической симптоматикой и нередко дебютирует явлениями цистита.
У детей младшего возраста острый пиелонефрит протекает с выраженным преобладанием симптомов общей интоксикации, что может явиться причиной диагностических ошибок. В старшем детском возрасте картина острого пиелонефрита сходна с таковой у взрослых.
Как и бактериемический шок, гнойные осложнения пиелонефрита чаще регистрируются у пожилых людей со сниженным иммунитетом. Другой клинической особенностью течения острого пиелонефрита у пожилых является преобладание общих симптомов — нарушения ментальности, развитие летаргии, снижение социальной активности, в то время как местные проявления выражены слабо, возможно, вследствие сниженного восприятия симптомов. Стертость клинической симптоматики в такой ситуации приводит к несвоевременной установке диагноза, запоздалому лечению, ухудшает прогноз.
Механизмы хронизации острого пиелонефрита во многом остаются неясными, но в первую очередь этому способствуют анатомические изменения мочевой системы (врожденные и приобретенные), сохраняющаяся обструкция, состояние макроорганизма, особенности возбудителя, адекватность терапии и т. д.
Хронический пиелонефрит. Клиническая картина хронического пиелонефрита обусловлена распространенностью воспалительного и склеротического процессов в почках, выраженностью воспаления, функциональным состоянием почек, сопутствующими заболеваниями. Основным морфологическим признаком хронического пиелонефрита, отличающим его от других тубулоинтерстициальных изменений, является обязательное вовлечение в процесс чашечно-лоханочной системы.
Вне обострения хронический пиелонефрит протекает с весьма скудной симптоматикой, с жалобами на утомляемость, снижение работоспособности и т. д., которые обычно не ассоциируются с конкретным заболеванием. Целенаправленный расспрос больных выявляет такие симптомы, как боли в поясничной области, эпизоды немотивированного субфебрилитета, познабливания, расстройства мочеотделения (полиурия, никтурия). Нередко единственным проявлением хронического пиелонефрита является изолированный мочевой синдром (лейкоцитурия, бактериурия, протеинурия, обычно не более 1 г/сут) или сочетание мочевого синдрома с анемией (в отсутствие почечной недостаточности), артериальной гипертензией.
Для подтверждения диагноза хронического пиелонефрита особую роль играет внутривенная урография, выявляющая снижение тонуса верхних мочевых путей, деформацию чашечек, пиелоэктазии. Компьютерная томография позволяет составить впечатление о массе и плотности паренхимы почек, состоянии лоханок, сосудистой ножки, паранефральной клетчатки. С помощью ультразвуковых методов уточняются размеры органа, можно обнаружить рентгеннегативные камни (уратные, цистиновые), внутрипаренхиматозные кисты.
Наиболее весомым диагностическим признаком хронического пиелонефрита является различие в величине и функции почек, подтверждаемое данными радиоизотопного исследования (ренография, динамическая сцинтиграфия).
Диагноз хронического пиелонефрита основывается главным образом на обнаружении этих различий.
В отсутствие визуализационных различий дифференциальный диагноз между собственно пиелонефритом и ИМП без специальных методов обследования представляет трудную задачу, что ведет к гипердиагностике пиелонефрита, «списыванию» на пиелонефрит других нозологических форм, подвергая больных риску длительного необоснованного лечения.
Бессимптомная бактериурия. Бессимптомная бактериурия (ББ) — бактериологический диагноз, который устанавливается при исследовании мочи, собранной с максимальным соблюдением стерильности и доставленной в лабораторию в предельно короткие сроки. По определению Американского общества инфекционных болезней (Infectious Diseases Society of America, IDSA), ББ — это изолированная бактериурия в образце мочи, полученном в условиях, исключающих контаминацию, и при отсутствии симптомов мочевой инфекции [21]. Диагноз ББ может быть установлен:
У женщин при ББ наиболее часто выделяется E. coli, тогда как для мужчин наиболее характерно выделение P. mirabilis, коагулазонегативных стафилококков и Enterococcus spp. [21]. Штаммы кишечной палочки, высеваемые при ББ у женщин, характеризуются меньшей вирулентностью, чем штаммы E. coli, выделенные от пациенток, страдающих клинически выраженными ИМП.
ИМП и беременность. Беременность является фактором риска развития как осложненной, так и неосложненной ИМП, которая у беременных нередко проявляется в виде ББ. Частота ББ у беременных составляет около 6%, острый цистит и острый пиелонефрит встречаются несколько реже — в 1–2,5% случаев, однако у 20–40% беременных с ББ во II и III триместрах развивается острый пиелонефрит [12, 25], а примерно у 1/3 пациенток, страдающих хроническим пиелонефритом, во время беременности отмечается обострение существующего до беременности заболевания [16].
Лечение ИМП. Как и при других бактериальных инфекциях, чувствительность возбудителей к антибиотикам имеет решающее значение при выборе препарата для эмпирической терапии ИМП. При этом структура возбудителей, вызывающих неосложненную ИМП, достаточно предсказуема, поскольку в 75–90% инфекцию вызывает E. coli. Антибиотикорезистентность, долгое время считавшаяся проблемой при лечении внутрибольничных и осложненных ИМП, в настоящее время становится актуальной и при лечении неосложненной ИМП.
В России в последние годы отмечается высокая частота устойчивости внебольничных штаммов E. coli к ампициллину (неосложненные инфекции — 37%, осложненные — 46%) и ко-тримоксазолу (неосложненные инфекции — 21%, осложненные — 30%), поэтому указанные препараты не рекомендуется использовать в качестве препаратов выбора для лечения ИМП [7].
Одними из наиболее часто используемых препаратов для лечения ИМП являются фторхинолоны, которые во многих международных руководствах указываются как препараты выбора в терапии ИМП. Однако в настоящее время отмечается быстрый рост резистентности уропатогенной E. coli к препаратам этой группы. Считается, что при уровне резистентности в популяции более 10% на применение препаратов вводятся ограничения. В России уровень устойчивости уропатогенной E. coli к фторхинолонам, по данным различных исследований, колеблется от 4,3% до 12,9%, составляя в среднем около 7–8% [1, 9, 17, 23].
Лучше всего поддается лечению неосложненная ИМП. Препаратами выбора при острой неосложненной ИМП являются пероральные фторхинолоны (левофлоксацин, норфлоксацин, офлоксацин, пефлоксацин). В случае их непереносимости можно использовать амоксициллин/клавуланат, фосфомицина трометамол, нитрофурантоин [7]. Использование налидиксовой кислоты и нитрофурантоинов имеет определенные недостатки в связи с необходимостью применения этих препаратов 3–4 раза в сутки, а также слабой активностью нитрофурантоина в отношении Proteus spp., а налидиксовой кислоты — в отношении S. saprophyticus [4].
Длительность терапии острого цистита при отсутствии факторов риска составляет 3–5 дней, острого пиелонефрита — не менее 2 недель. При остром цистите фосфомицина трометамол применяется однократно. При острой осложненной ИМП или при наличии факторов риска применяются те же антимикробные препараты, что и при неосложненной ИМП, однако длительность терапии увеличивается до 7–14 дней или более — в отсутствие эффекта [19].
В ряде рандомизированных контролируемых исследований (G. Iravani и соавт., 1998; P. Diakos и соавт., 1987; C. Naber и соавт., 1998; H. Asbach и соавт., 1991) была продемонстрирована эффективность цефалоспоринов III поколения (цефиксим 400 мг однократно; 200 мг 2 раза в сутки) в лечении как неосложненной, так и осложненной ИМП [8], которые в ряде случаев (например, акушерской и гинекологической практике) являются препаратами выбора. Отличительной чертой цефалоспоринов III поколения является высокая активность в отношении микроорганизмов семейства Enterobacteriaceae, устойчивость к действию бета-лактамаз, длительный период полувыведения [13].
В детском возрасте, по сравнению с взрослыми, антибактериальная терапия пиелонефрита проводится более длительным курсом, причем чем младше ребенок, тем длиннее может быть курс терапии. Это связано с несовершенством общего иммунитета и местных факторов защиты мочевых путей, наличием анатомических и длительно сохраняющихся функциональных вариантов обструкции току мочи, что создает предпосылки для возникновения рецидивов ИМП. Поэтому лечение острого неосложненного пиелонефрита проводится в два этапа — стартовая антибиотикотерапия (14–20 дней), затем противорецидивная терапия уросептиками с постепенным снижением дозы препарата (до 28 дней). При наличии анатомической обструкции, связанной с различными аномалиями развития мочевой системы, пузырно-мочеточникового рефлюкса, а также нарушении иннервации тазовых органов, длительность противорецидивной терапии может составлять несколько месяцев или даже лет вплоть до ликвидации первопричины заболевания. Выбор, способ введения и доза антибиотика для стартовой терапии пиелонефрита зависят от возраста ребенка и тяжести течения заболевания [19].
Детям первых 3 месяцев жизни назначаются парентерально цефалоспорины III и IV поколений (цефотаксим — 50 мг/кг/8 ч, цефтриаксон — 50 мг/кг/24 ч, цефтазидим — 30–50 мг/кг/8 ч, цефепим — 50 мг/кг/24 ч) и аминогликозиды (нетромицин — 2,5 мг/кг/8 ч, амикацин — 10 мг/кг/8 ч, гентамицин — 2,5 мг/кг/8 ч). У детей старше трех месяцев жизни при легком и среднетяжелом течении пиелонефрита используются перорально защищенные пенициллины (амоксициллин/клавунат — 40–60 мг/кг/24 ч) и цефалоспорины III поколения (цефтибутен — 9 мг/кг/24 ч, цефиксим — 8 мг/кг/24 ч); при тяжелых формах — парентерально цефалоспорины III (цефотаксим — 50–100 мг/кг/24 ч, цефтриаксон — 50–75 мг/кг/24 ч, цефтазидим — 50–100 мг/кг/24 ч) и IV поколений (цефепим — 50 мг/кг/24 ч) и аминогликозиды (гентамицин — 3–5 мг/кг/24 ч, нетромицин — 4–7,5 мг/кг/24 ч, амикацин — 15–20 мг/кг/24 ч) [2, 24].
Для противорецидивной терапии у детей используются производные 5-нитрофурана (Фурагин — 6–8 мг/кг/24 ч, не более 200 мг/24 ч, Фурамаг — 5 мг/кг/24 ч, не более 400 мг/24 ч), производные пипемидиновой кислоты (Палин — 15 мг/кг/24 ч), налидиксовой кислоты (Неграм, Невиграмон — 55 мг/кг/24 ч), производные 8-оксихинолина (5-НОК, нитроксолин — 5–8 мг/кг/24 ч). Фторированные хинолоны в детском возрасте применяются только по жизненным показаниям [2, 6].
Беременным женщинам с ББ антимикробная терапия показана при развитии бактериурии после трансплантации почки и перед планирующимися урологическими вмешательствами. Лечение ББ снижает у них риск развития пиелонефрита на 20–35%, а также процент преждевременных родов и внутриутробной гипотрофии плода [3, 21].
ББ у женщин, страдающих сахарным диабетом (СД), выявляется достаточно часто. Однако анализ большого числа исследований показал, что выявление ББ и проведение антибактериальной терапии в этой группе больных не приводит к уменьшению частоты заболеваний мочевыводящих путей и осложнений диабета. В то же время у пациенток данной группы наблюдается большее число осложнений антибактериальной терапии, таких как дисбактериоз кишечника, системный кандидоз, аллергические реакции и пр. Таким образом, антимикробная терапия при ББ в большинстве случаев, включая у больных СД, по-видимому, необоснованна [5, 11].
При хроническом пиелонефрите обострения общепринято лечить как острый пиелонефрит. Не подлежит сомнению необходимость устранения обструкции, восстановления нормального пассажа мочи, стимуляции иммунитета, профилактики обострений ИМП. Значение этих мероприятий особенно показательно у детей с пузырно-мочеточниковым рефлюксом и рефлюкс-нефропатией.
Вне обострения пиелонефрита желательно применение растительных уросептиков в сочетании с профилактическими мероприятиями — употребление не менее 2 литров жидкости в сутки, регулярное опорожнение мочевого пузыря, обязательное в ночное время и после полового сношения, борьба с запорами. Противорецидивные курсы антибиотиков с ежемесячной сменой препарата неоправданны.
Неосложненная мочевая инфекция (в т. ч. неосложненный пиелонефрит) практически не приводит к развитию хронической почечной недостаточности (ХПН). Основной причиной терминальной почечной недостаточности в настоящее время является не хронический пиелонефрит, а СД и артериальная гипертензия, удельный вес которых в структуре ХПН постоянно увеличивается. Для предупреждения или замедления прогрессирования ХПН у больных хроническим пиелонефритом значение имеют не длительная антибиотикотерапия, а жесткий контроль артериального давления и коррекция метаболических нарушений, таких как гиперлипидемия, гиперурикемия и т. д.
Литература
В. М. Ермоленко, доктор медицинских наук, профессор
Н. Н. Филатова, кандидат медицинских наук, доцент
А. В. Малкоч, кандидат медицинских наук, доцент
ГБОУ ДПО РМАПО Минздравсоцразвития России, Москва
.gif)